Cancer Cell |彭吉润、张泽民课题组合作
解析肿瘤免疫微环境形成因素
2022年3月17日,我院胃肠肝胆肿瘤外科彭吉润教授课题组和北京大学生物医学前沿创新中心(BIOPIC)张泽民教授课题组合作,在国际期刊Cancer Cell上以Article形式在线发表了题为Immune phenotypic linkage between colorectal cancer and liver metastasis的研究论文。

肿瘤微环境(TME)特征与免疫检查点抑制剂的治疗效果密切相关,系统解析肿瘤微环境中不同免疫细胞的表型,是理解肿瘤发生、发展机理以及提高免疫治疗效果的关键。肿瘤微环境是如何形成的?是癌细胞恶变主导,还是所在器官的局部环境主导?还是彼此之间既有协同又有博弈而共同塑造?本研究以结直肠癌肝转移为模型,利用单细胞转录组测序技术系统研究了这一问题,给出了新认识、新见解。
该研究中,课题组收集了一组未经治疗的结直肠癌肝转移(CRLM)患者包括原发肠癌及癌旁组织、肝转移癌及癌旁组织、肠系膜淋巴结和外周血在内的配对样本,对32万3千多个细胞进行了10x Genomics测序,同时还对5000多个细胞采用Smart-seq 2方法进行了测序验证。通过整合多种scRNA-seq平台的表达谱数据和T细胞受体(TCR)序列测序结果,研究人员构建了结直肠癌肝转移患者多种组织的高分辨率免疫细胞转录组图谱,并为后续相关研究工作提供了极有价值的数据资源。
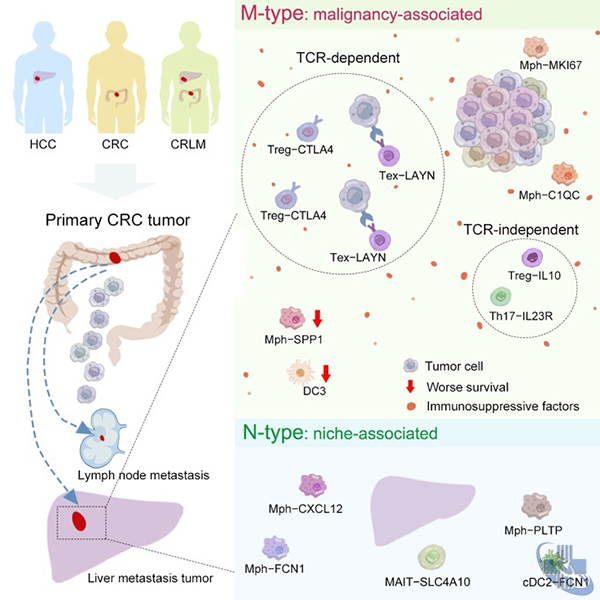
为了量化分析了肿瘤细胞成分(Malignancy)和驻留组织/器官生境(Niche)对各种免疫细胞不同表型的影响,研究人员设计了一种被称为PhenoAligner的新生信算法,表型显著受到恶性肿瘤细胞影响的免疫类群被定义为M-type,而表型显著受到组织/器官生境影响的免疫类群则被定义为N-type。在免疫细胞大类水平上,自然杀伤细胞(NK)、树突状细胞(DC)和自然杀伤T细胞(NKT)都被划分为N类,肥大细胞(MAST)则是唯一被划分为M类的免疫细胞群体。在细胞亚群水平上,CD8+ T细胞中,耗竭型T细胞(Tex)被PhenoAligner识别为M类;而在CD4+ T细胞中,则有四个亚类Treg-CTLA4、Th17、Th1-like和Treg-IL10被识别为M类。
课题研究方案及主要结论
在此基础上,研究人员还识别出多种与肿瘤进展或转移相关的关键性免疫细胞。例如,首次在CRLM患者的肿瘤中鉴定出了一种新的DC2亚型DC3s,其表达的特征基因与疾病预后较差相关。此外,研究人员鉴定出三群分别高表达SPP1、 C1QC和MKI67的肿瘤相关巨噬细胞(TAM)。其中,C1QC+ TAM可能会在CRLM患者的免疫治疗中发挥有益作用,与之相反,SPP1+ TAM主要发挥促进血管生成和肿瘤转移的功能,并和更差的疾病预后相关,对其进行功能抑制可能会在CRLM患者的治疗中发挥积极作用。
北京大学BIOPIC/生命科学学院博士生刘烨丹及张启明为该论文的并列第一作者,我院彭吉润教授和北京大学BIOPIC张泽民教授、任仙文教授为该论文的共同通讯作者,我院外科的罗楠博士以及北京大学肿瘤医院的邢宝才、步召德教授也参加了此项研究。该研究得到北京市科委、国家自然科学基金、国家重点研发计划、ICG的支持和资助。
彭吉润教授简介

彭吉润,医学博士、教授、主任医师、博士研究生导师,8455线路检测中心胃肠/肝胆肿瘤外科主任。长期从事肝胆胰外科诊疗及研究工作,擅长肝癌、肝转移癌、胆管癌、胆囊癌、胰腺癌、门静脉癌栓的手术、微创消融治疗,以及靶向药物治疗和免疫治疗,并擅长肝硬化门静脉高压症的外科治疗。近年来在Cell、Cell Research、Gut等国内外核心期刊发表论文约80余篇,主译了第十九版《克氏外科学》。曾荣获1994年度卫生部科技进步三等奖,2007年度教育部科学技术奖一等奖、中华医学科技奖二等奖、2008年度北京市科学技术奖二等奖以及2021年度北京市自然科学奖一等奖。
上一篇: 晚期胰腺癌治疗也有招儿
下一篇: 消防安全检查










